25 ++ 化学式 酢酸イオン 505096-酢酸イオン 化学式
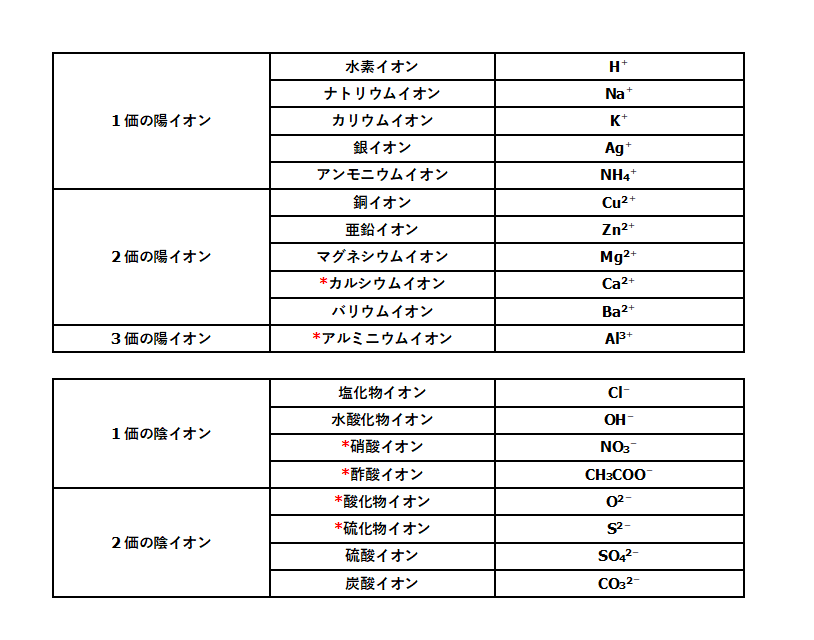
イオン式の一覧を中学生向けに作成 しました。 さっそくイオン式の一覧を下に載せますが、 その下にはさらに、 化学式やイオン式の確認と解説 や イオン式の練習問題 も作ったので、ぜひ勉強に活用してください! これだけは覚えたいイオンを表す化学式 (イオン式)一覧 ここでは,中学3年生で出てくるイオンを表す化学式についてまとめます. 原子記号と同じように世界共通の記号ですので,キッチリ覚えてください. イオンのでき方に関しては,こちらの記事を 酢酸スズ (II)(Tin (II) acetate) は,化学式 Sn (CH3COO)2 で表される有機化合物です。 目次 Table of contents

組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ
酢酸イオン 化学式
酢酸イオン 化学式- になっていますが、イオン反応式ではなく、化学反応式として書く必要があるため、 NH 4 Cl NaOH → NH 3 H 2 O NaCl さいごに 弱酸遊離・弱塩基遊離は、無機化学、有機化学を学ぶうえで基礎知識として必要となる話です。カリウムイオン カルシウムイオン ag+ zn2 2 so 4 - oh- 銀イオン 亜鉛イオン 硫酸イオン 水酸化物イオン nh 4 + cu2 2 co 3 - no 3- アンモニウムイオン 銅イオン 炭酸イオン 硝酸イオン 2 ba coo ch 3 - バリウムイオン 酢酸イオン 陽イオン 陰イオン



イオン式の一覧 中学生用
の 酢酸ナトリウム, エタン酸ナトリウム(NaOAcと略される)としても知られる、酢酸のナトリウム塩である。その化学式はchです 3 ナトリウムイオンと酢酸イオンの間にイオン結合を持つcoona この化合物は植物や動物の組織に自然に存在します。それは、無水または三水和物のいずれの形態でも 弱酸(酢酸水溶液)の電離度と pH の求め方(高校化学) 5 June 16 酢酸などの弱酸は一部の分子が電離して水素イオンを放出する。 電離する割合を電離度という。 水溶液の pH は電離度などから計算される。 酢酸は水に溶けても完全に電離しないので 酢酸の化学式 なぜ酢酸ch3coohの化学式だけは 陰イオン、陽イオンの順に書くのでしょうか? また、酢酸鉛は(ch3coo)2pbと書くべきでしょうか、pb(ch3coo)2と書くべきでしょうか? 酢酸の方は1通りしか表記を見ませんが、酢酸鉛ではどちらの表記も目にすることが
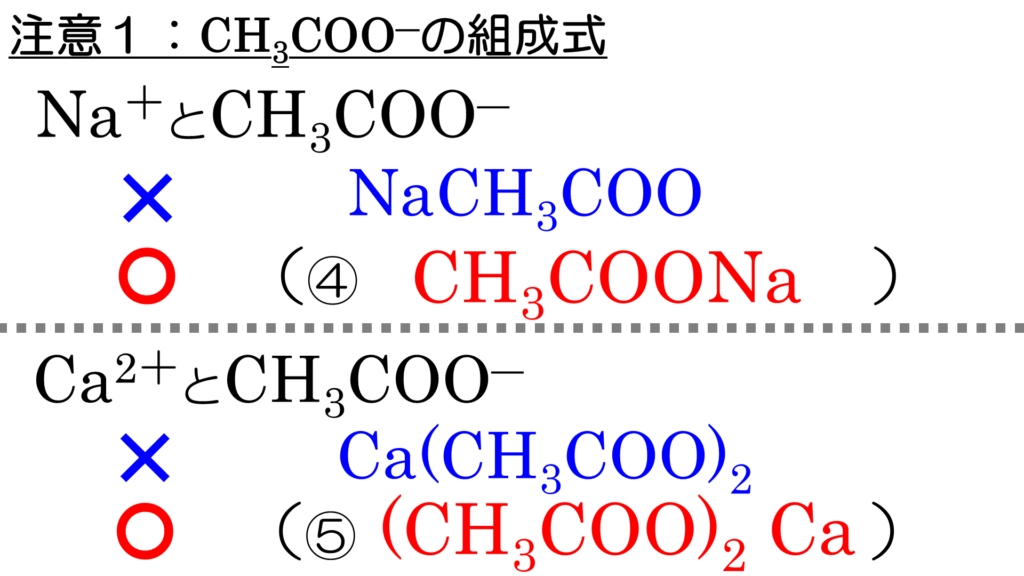
*A ☞「ctrl」「F」で、検索できます。 Ac アクチニウムactinium Ac 227 半減期218年 Ac- 酢酸イオンacetate ion Ag 銀silver 47Ag(2 8 18 18 1) 面心立方格子facecentered cubic lattice Ag 銀イオンsilver ion AgAc 酢酸銀silver acetate Ag3AsO3 亜ヒ酸銀silver arsenite Ag3AsO4 ヒ酸銀silver arsenate AgBO3 メタホウ酸銀silver metaborate AgBr 酢酸イオンを先に書く。 2)その他の化学式(イオンからなる物質以外) ① 単体の化学式 単体:1種類の元素からなる物質。同素体を元素名と物質名が同じもの(ダイヤモンドなど同素体は 酢酸の電離度 その他の例として、1 mol の酢酸を 1 L の水に溶かした場合を考えます。このとき、001 mol の酢酸が電離しているとすると、電離度は 001 になります。 $$α = \frac{001mol}{1mol} = 001$$ 酢酸が水の中で電離する化学反応式は、次のようになります。
概要–酢酸vsプロピオン酸 酢酸は化学式chを持つ2番目に単純なカルボン酸です 3 cooh、プロピオン酸は化学式chを持つ3番目の単純なカルボン酸 3 ch 2 co 2 h酢酸とプロピオン酸の主な違いは、酢酸は2つの炭素原子を含むカルボン酸であるのに対し、プロピオン酸は3つの炭素原子を含むカルボン酸 電離式の一覧を中学生向けに作成 しました。 さっそく電離式の一覧を下に載せますが、 その下にはさらに、 電離の解説 や、 電離式の練習問題がある ので、ぜひ勉強に活用してください! 酸性の水溶液になる電離式 赤字がよく出るもの ① 塩酸の電離 ビス(チオスルファト)銀(Ⅰ)酸イオン Ag (S2O3)23ー 3 以上、『試験に出るイオン式一覧 暗記表錯イオン一覧付き』を紹介しました。 H+ 、 Na+ など基本のイオン式は中学から学んできたと思いますが高校ではこれらの数が増え、更に複雑な錯




このいい覚え方があったら教えてください Clearnote




エタノールの燃焼反応の化学反応式を教えてください 理由も書いてくださると嬉しいで アンサーズ
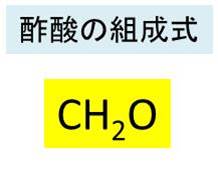
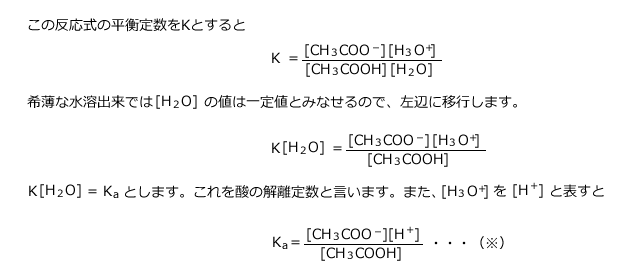
ch3cooh→ch3coo hというイオン式に関して質問です。「酢酸を水に溶かした時の変化をイオン式で表せ」という問題なのですが、解答には上記の式が解答として記載されています。この式をch3cooh→h ch3cooと、順番を変えて解答した 酢酸の分子量の計算 ここまでで分子量については理解できたと思うので、さっそく酢酸の分子量を計算してみましょう。 まず、酢酸の化学式は、 $$ c_{2}h_{4}o_{2} $$ です。 原子の結合順序がわかるように書いた 示性式 で表した場合は、 $$ ch_{3}cooh $$ 酢酸及び酢酸イオンの表記について、いちいち化学式で書くのは面倒なので、酢酸(CH 3 COOH)をAH, 酢酸イオン(CH 3 COO)をAと書くことにする。ちなみにAはacidの略。したがって、K a についての式は次のように書き直される。 酢酸の全濃度をCとすると、




これだけは覚えたいイオンを表す化学式 イオン式 一覧 Hiromaru Note




イオン式とは 価数とは 書き方や語呂合わせの覚え方 暗記法まとめ 高校化学の問題の解き方も 受験の相談所
酢酸 ch 3 cooh ⇔ (ch 3 coo) (h )、水 h 2 o ⇔ (h ) (oh) 酸、塩基、塩の化学式では、HCl、NaOH、NaClのように陽イオンを先に陰イオンを後に書きます。 そのため、電離平衡の式でも陽イオンを先に書くのが普通です(HCl ⇄ H Cl )。の アンモニウムイオン 化学式がnhである正電荷を帯びた多原子カチオン 4 分子は平らではなく、四面体の形をしています。 4つの水素原子が4つの角を作ります アンモニアの窒素は、プロトン(ルイス塩基)を受容することができる一対の非共有電子を有するので、アンモニウムイオンは 例:no 3 – (硝酸イオン)so 4 2(硫酸イオン)po 4 3(リン酸イオン)co 3 2(炭酸イオン)ch 3 coo – (酢酸イオン)、hco 3 – (炭酸水素イオン) イオン式の一覧 イオン式は、まず単原子イオンの場合は、典型元素は規則性があります。1族は電子を1つ投げたら閉殻構造になりますので 1、2族



電離式の小テスト 3年理科 Takaの授業記録11



緩衝液 仕組み 共通イオン効果 濃度を使ったph計算の解き方など 化学のグルメ
酢酸イオンと水の反応 CH₃COO¯H₂O⇒CH₃COOHOH¯において、水は塩基として働い ベストアンサー:水は酢酸イオンに水素イオンを渡しているので、酸として働いている。 1 1/9 902 化学 酢酸をイオン式で表したら、CH3COO− + H になると書いてありました酢酸イオンのほか、ベンゼンでも共鳴構造が見られる。(※ ベンゼンの共鳴については、高校化学でも習う。) 本ページでは例として酢酸について記述したが、もちろん酢酸以外のカルボン酸でも同様に、共鳴の原理は成り立つ。 古典的な共鳴理論の限界 酢酸の化学式はCH 3 COOHで、1価の弱酸です。つまり、大部分は酢酸分子CH 3 COOHで、ほんの少しだけ解離して、酢酸イオンCH 3 COO – とヒドロニウムイオンH 3 O になっています。 例題① 010mol/Lの酢酸溶液のpH計算方法 例題 010mol/Lの酢酸溶液のpHを有効数



スマホで危険物 学習帖 配位結合と特別なイオン F M サイエンスブログ



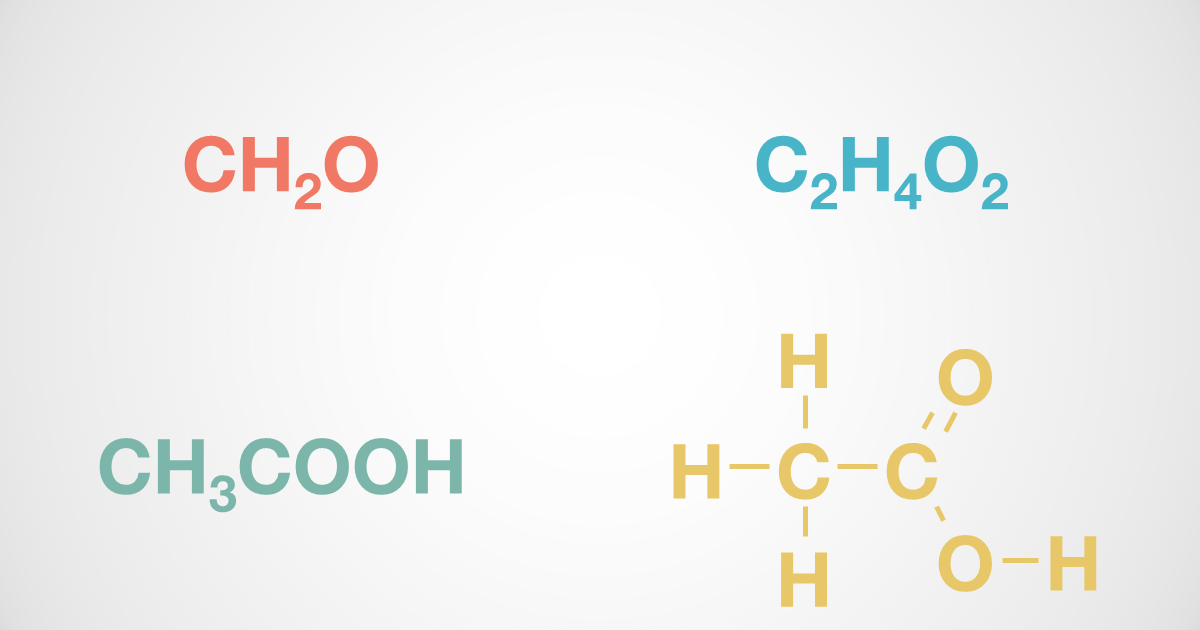
酢酸の化学式 分子式 構造式 電子式 イオン式 分子量は 酢酸の電離の反応式は
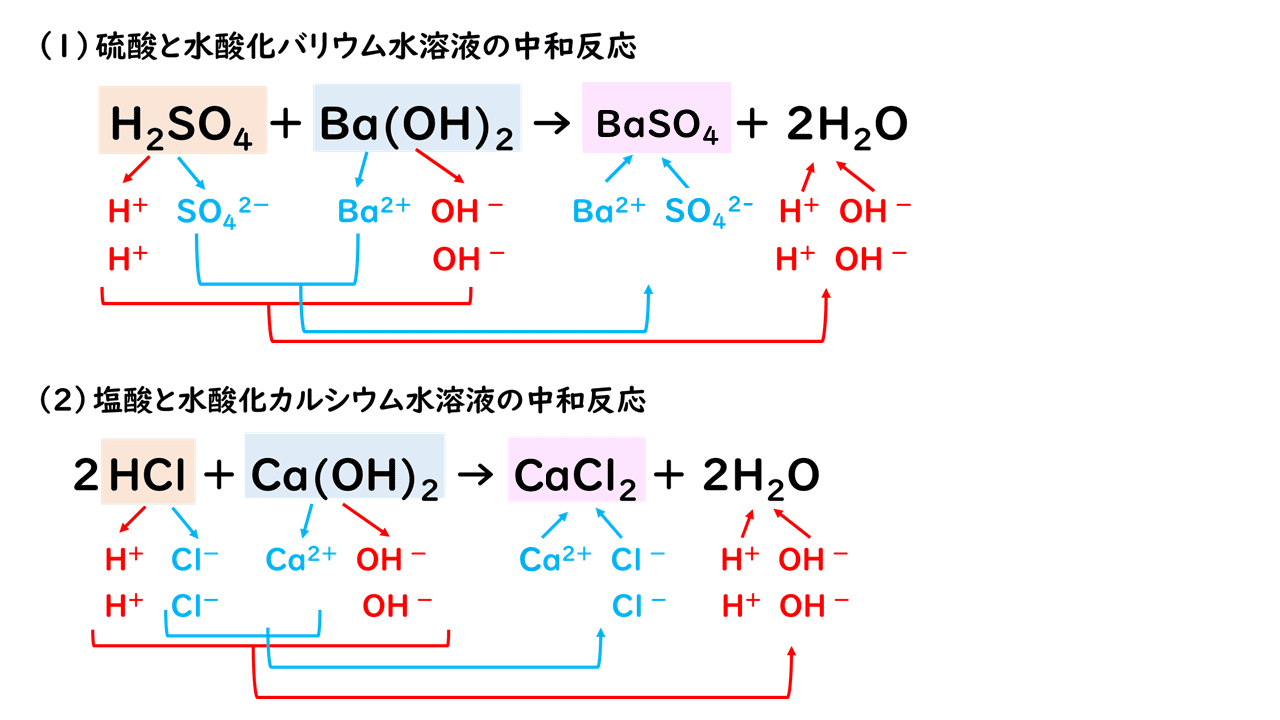
分子式 c 6 h 8 o 7 は、クエン酸分子を構成する 原子の種類と数のみ を示し、分子構造や性質は伝えられない化学式です。 構造式 は分子構造、すなわち、 原子の繋がり方を示す 化学式です。 図を使用することで、分子の構造や性質を、一番わかりやすく表現できます。水酸化ナトリウムの化学式とイオン式の書き方 結論から言えば・・・ 水酸化ナトリウムの化学式は、NaOH。 イオン反応式は、NaOH+HCI→ H2O NaCl。 今回は、水酸化ナトリウムの化学式を紹介します。 水酸化ナトリウムはあまり私たちの生活とはなじみが 酸と塩基 塩化水素(塩酸) hcl や硝酸 hno 3 、硫酸 h 2 so 4 、酢酸 ch 3 cooh 、炭酸 h 2 co 3 などは 酸 と呼ばれる物質です。 (塩化水素が水に溶けた水溶液のことを、塩酸といいます。) 酸の一般的な特徴は、酸っぱい味がして、青いリトマス紙を赤く変色させます。



中3化学 イオンとは 中学理科 ポイントまとめと整理



化学式とは 一覧表 語呂合わせの覚え方 練習問題付き 中学理科 テラコヤプラス By Ameba
1/121 覚えたい元素記号と化学式 何度も繰り返して覚えよう! 元素記号 は原子番号を示す。 44!これだけ覚えれば,大学入試も完璧です。 1水素 H 2ヘリウム He 3リチウム Li 4ベリリウム Be 5ホウ素 B 6炭素 C 7窒素(チッ素) N 8酸素 O 9フッ素 F Hirokikiです。 今回は共鳴構造について学んでいきましょう。 共鳴構造は、一言で言うと電子が局所的にどの原子に存在しているのかを表した構造のことです。 酢酸イオンを用いて説明していきたいと思います。 酢酸イオンの共鳴構造を図1に示します。 図143 rows イオン式一覧 プロ講師解説このページでは『イオン式一覧』について解説しています。 解説は高校化学・化学基礎を扱うウェブメディア『化学のグルメ』を通じて6年間大学受験に携わるプロの化学講師が執筆します。




硫酸イオンと 硫酸の化学式はなぜ違うのですか 硫酸にはなぜhがつくのに 硫酸イ アンサーズ
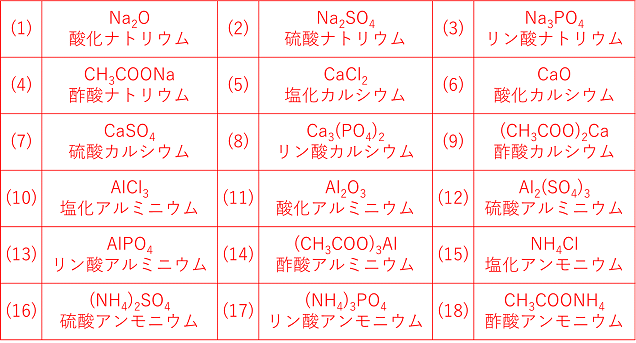



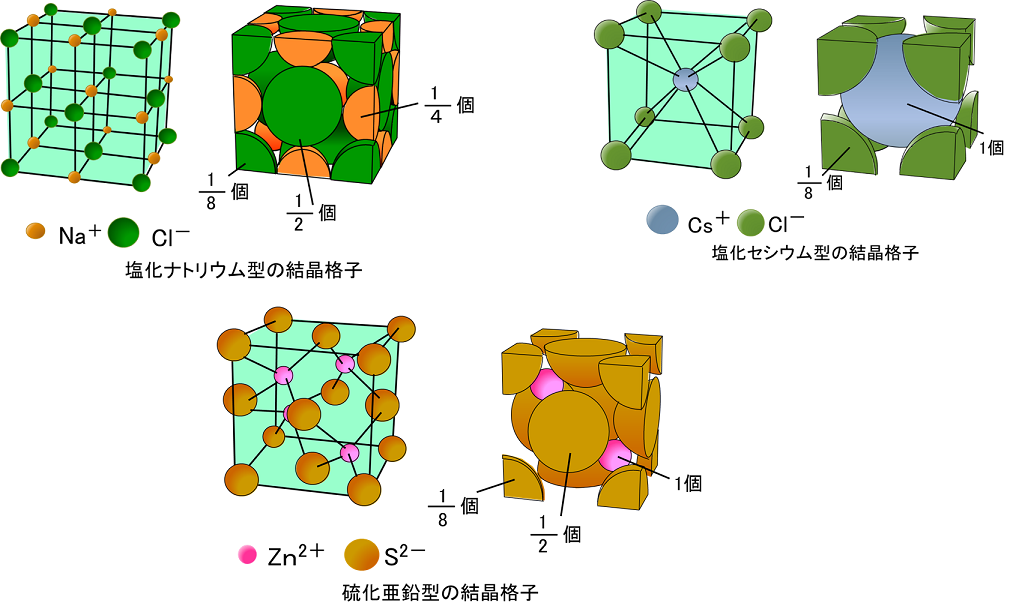
イオン結合とイオンからなる物質
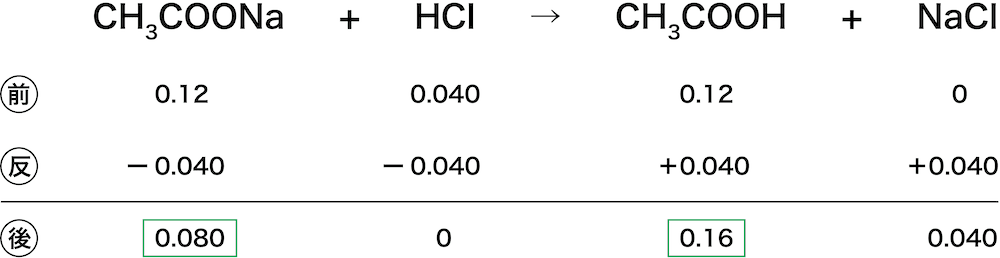
酢酸塩(さくさんえん、Acetate)またはエタン酸塩(ethanoate)は、酢酸イオン(CH3COO、AcO − )を持つ塩である。 酢酸塩には酢酸銅や酢酸ナトリウムなどがある。 なお、英語の Acetate および ethanoate は酢酸エステルのことも指すが、酢酸エステルは酢酸イオンを含まない点で酢酸塩と異なる。 酢酸ナトリウムは塩なので、完全に電離する。(上の式) 酢酸も(電離度を考慮しなくてはならないが)電離する。(下の式) しかし、これらが混合液になったとき、普段とは少し異なった反応を示す。 酢酸ナトリウムの方は、通常通り電離する。 \
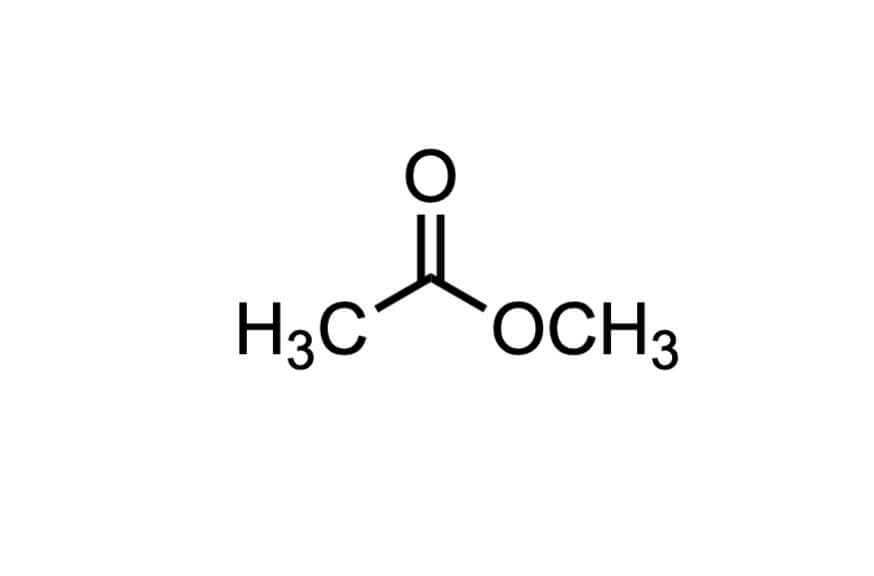



酢酸メチル



2
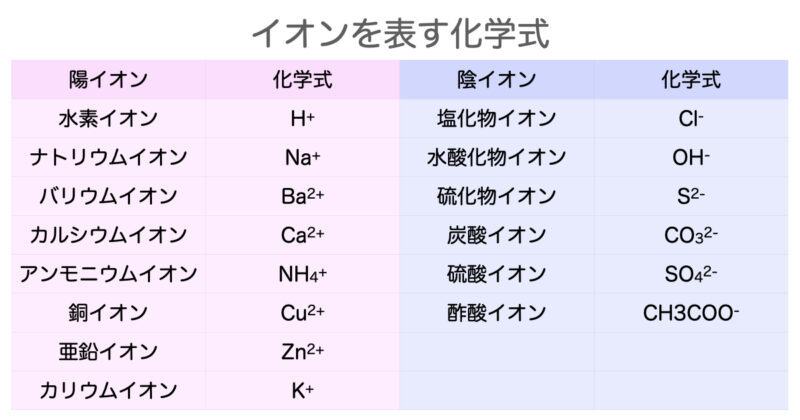



これだけは覚えたいイオンを表す化学式 イオン式 一覧 Hiromaru Note



酢酸カリウム You Iggy




高校化学 酢酸ナトリウムの加水分解 映像授業のtry It トライイット




高校化学基礎 酸の価数 映像授業のtry It トライイット




イオン結合とイオンからなる物質




授業に潜入 おもしろ学問 自然科学科目群 化学 化学概論 I 中村敏浩 教授 京都大学広報誌 紅萠



酢酸 Wikipedia



3




化学の質問です Clearnote




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ



化学式 物質の表し方のいろいろ 図解でわかる危険物取扱者講座
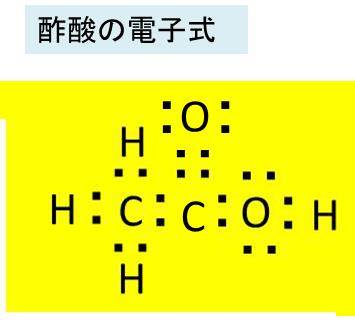



酢酸の化学式 分子式 構造式 電子式 イオン式 分子量は 酢酸の電離の反応式は



受験基礎化学 19 化学反応式と物質量 みかみの参考書ブログ



化学講座 第56回 化学反応速度 弱酸 弱塩基の電離 私立 国公立大学医学部に入ろう ドットコム



6 4 塩とその性質 おのれー Note




高校化学基礎 水素イオン濃度とは 映像授業のtry It トライイット
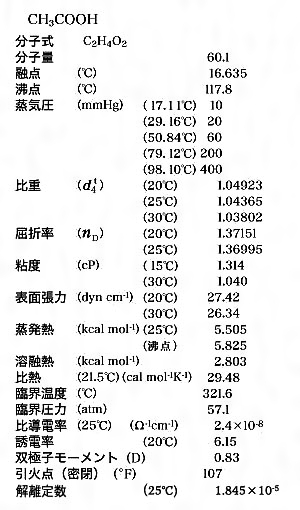



酢酸とは コトバンク




都立高校入試理科のイオンの傾向と対策 イオン式 電離式を押さえよう 高校入試徹底対策ガイド




いろいろな化学式 化学基礎



2




強酸と弱酸まとめ 見分け方 理系ラボ




高校化学 酢酸ナトリウムの加水分解 映像授業のtry It トライイット



3
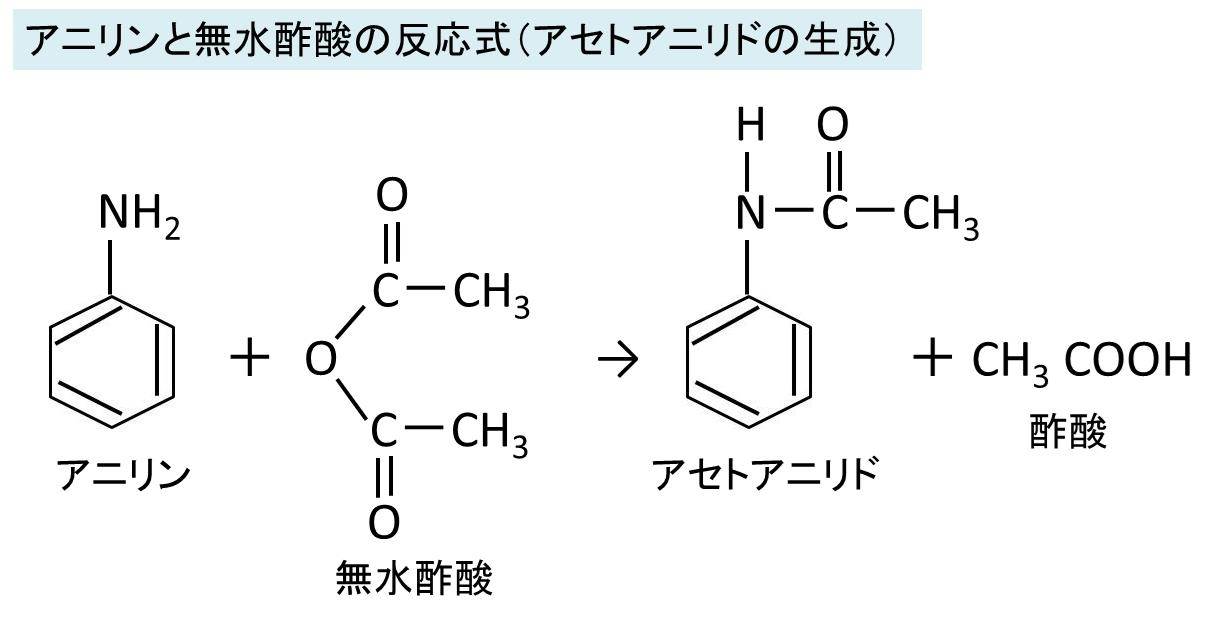



アニリンと無水酢酸の反応式 アセトアニリド生成 酢酸を使用しない理由は
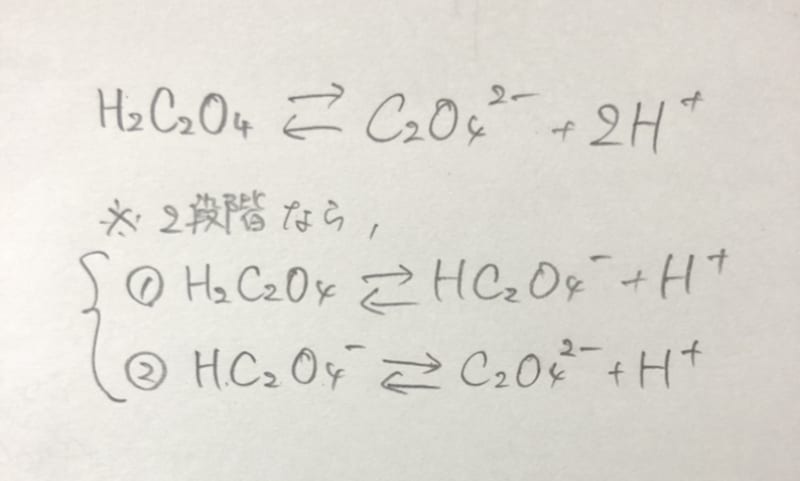



シュウ酸の電離式を教えてください アンサーズ
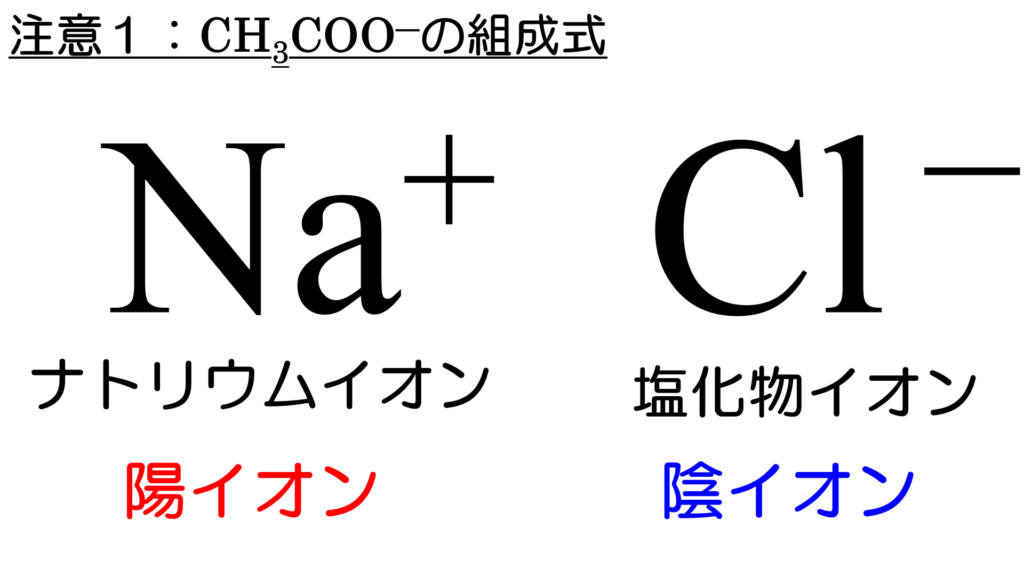



スマホで危険物 学習帖 配位結合と特別なイオン F M サイエンスブログ



3
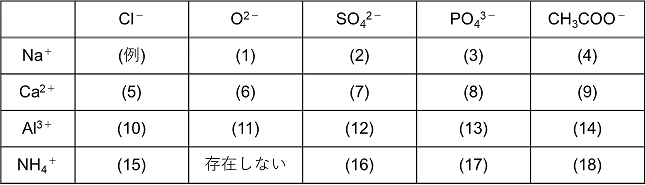



イオン結合とイオンからなる物質




化学 酸 塩基の価数 オンライン無料塾 ターンナップ




都立高校入試における化学反応式の傾向と対策とは 重要な式を覚えて得点源にしよう 高校入試徹底対策ガイド
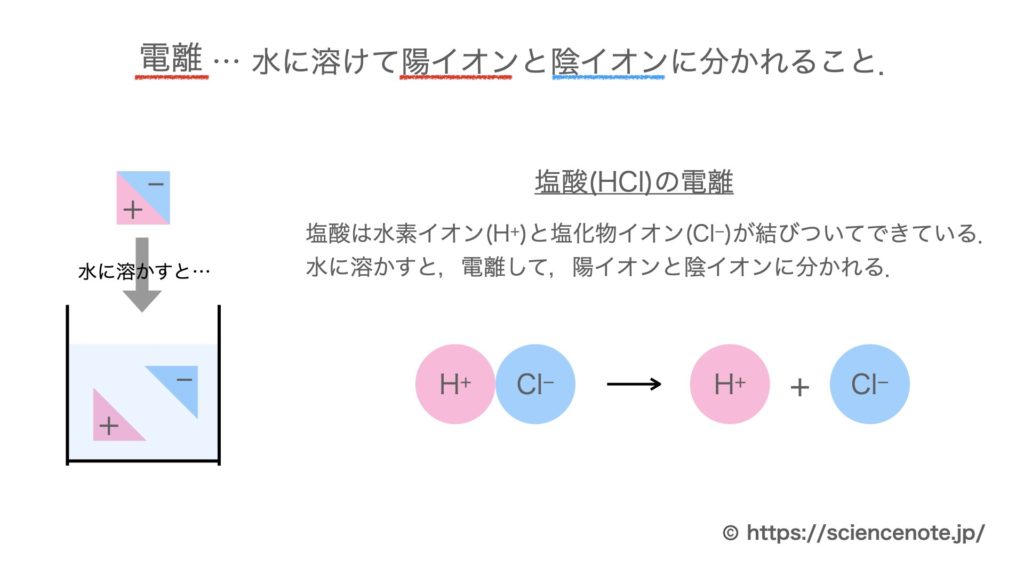



電離とは 電離式まとめ10選 中学化学 Hiromaru Note
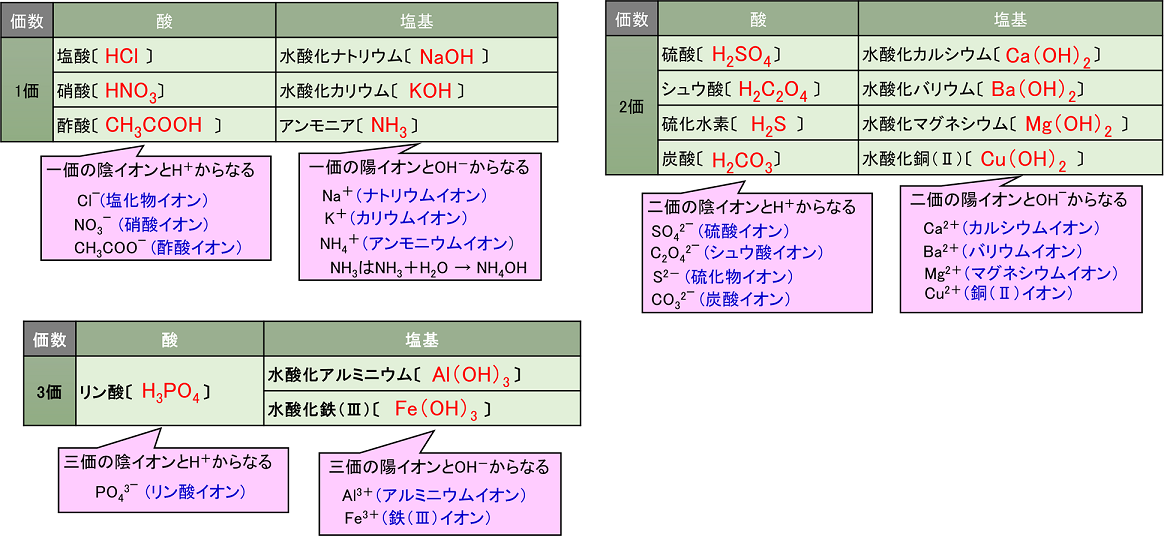



酸と塩基



イオン式の一覧 中学生用




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ



イオン結合とイオンからなる物質




授業に潜入 おもしろ学問 自然科学科目群 化学 化学概論 I 中村敏浩 教授 京都大学広報誌 紅萠



化学式とは 一覧表 語呂合わせの覚え方 練習問題付き 中学理科 テラコヤプラス By Ameba




組成式をスラスラ書けるようにしよう 化学がちょっとだけ好きな社労士
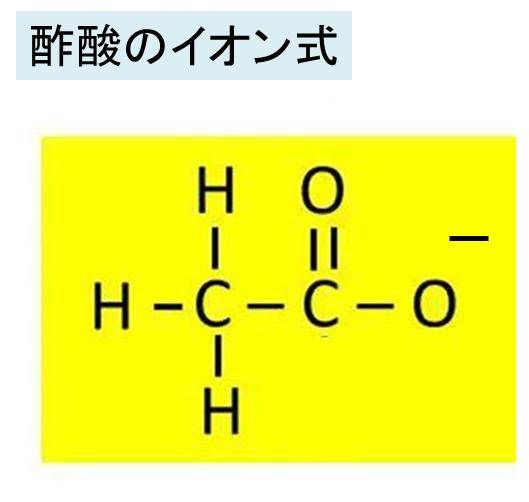



酢酸の化学式 分子式 構造式 電子式 イオン式 分子量は 酢酸の電離の反応式は




電子e を用いた酸化還元反応式の簡単な作り方があれば教えて頂きたいです 酸化 Clearnote
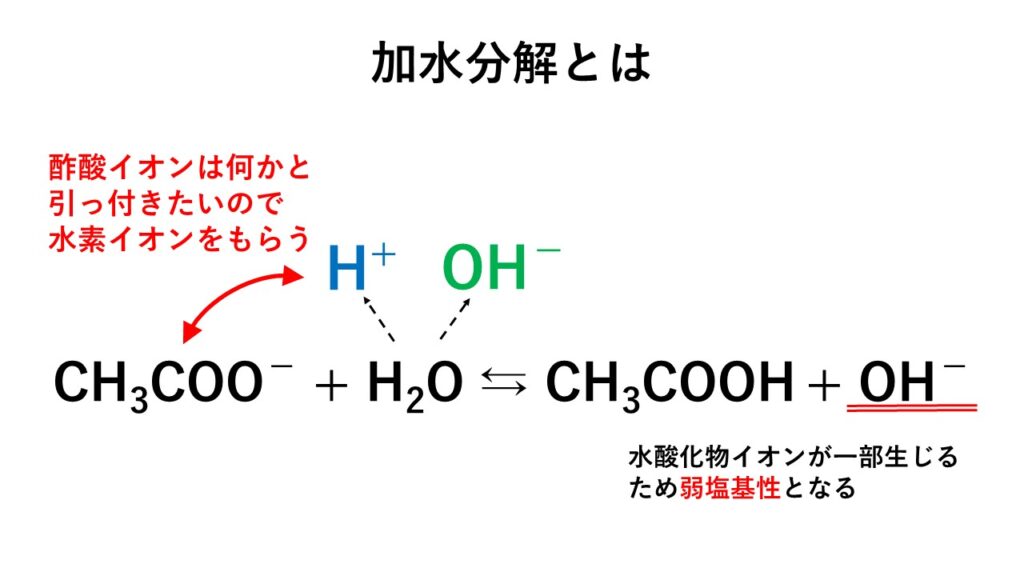



5分でわかる 塩の加水分解と塩の種類と分類 液性を解説 サイエンスストック 高校化学をアニメーションで理解する



酢酸イオンのイオン式と式量を教えてください イオン式ch Yahoo 知恵袋




いろいろな化学式 化学基礎



化学式とは 一覧表 語呂合わせの覚え方 練習問題付き 中学理科 テラコヤプラス By Ameba



化学基礎の酸と塩基が中和反応するときの化学反応式について 反 Yahoo 知恵袋
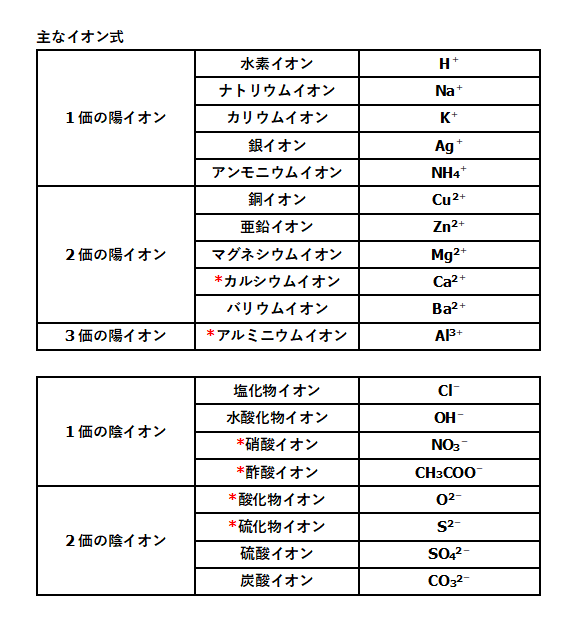



イオン式 電離式まとめ 中学理科 ポイントまとめと整理
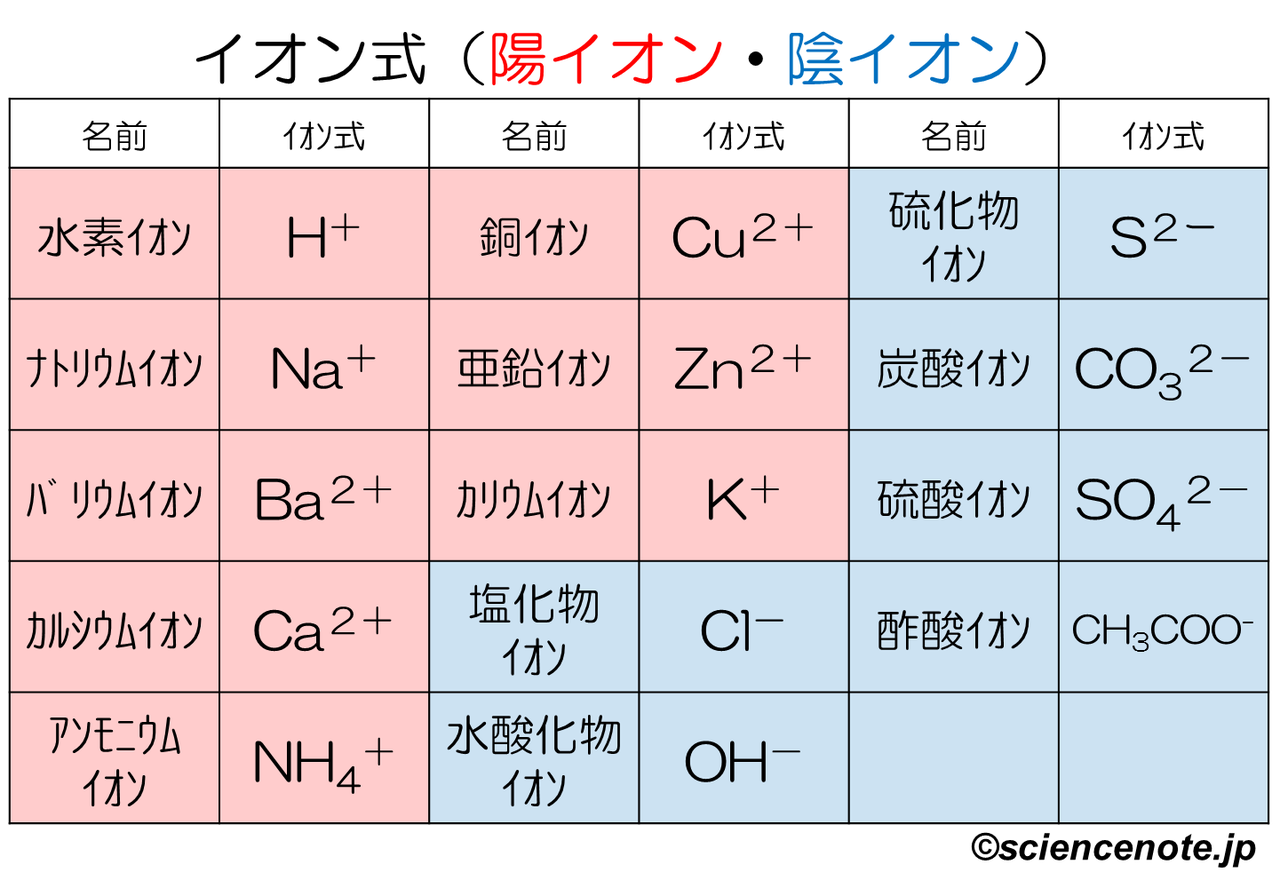



これだけは覚えたいイオンを表す化学式 イオン式 一覧 Hiromaru Note
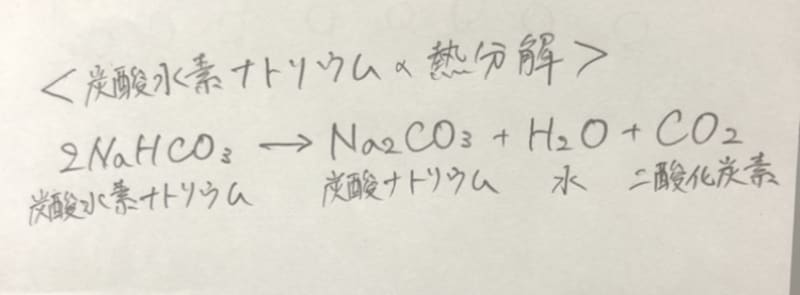



炭酸水素ナトリウムの化学反応式を教えてください アンサーズ



化学式 単体 物質名 化学式 物質名 化学式 物質名 化学式 水素 マグネシウム 鉄 ヘリウム アルミニウム 銅 炭素 硫黄 亜鉛 窒素 塩素 銀 酸素 カリウム バリウム ナトリウム カルシウム 水銀 水素 H2 ヘリウム He 炭素 C 窒素 N2 酸素 O2 ナトリウム




授業に潜入 おもしろ学問 自然科学科目群 化学 化学概論 I 中村敏浩 教授 京都大学広報誌 紅萠



酢酸 ねこでもわかる化学



酢酸鉛 Ii You Iggy
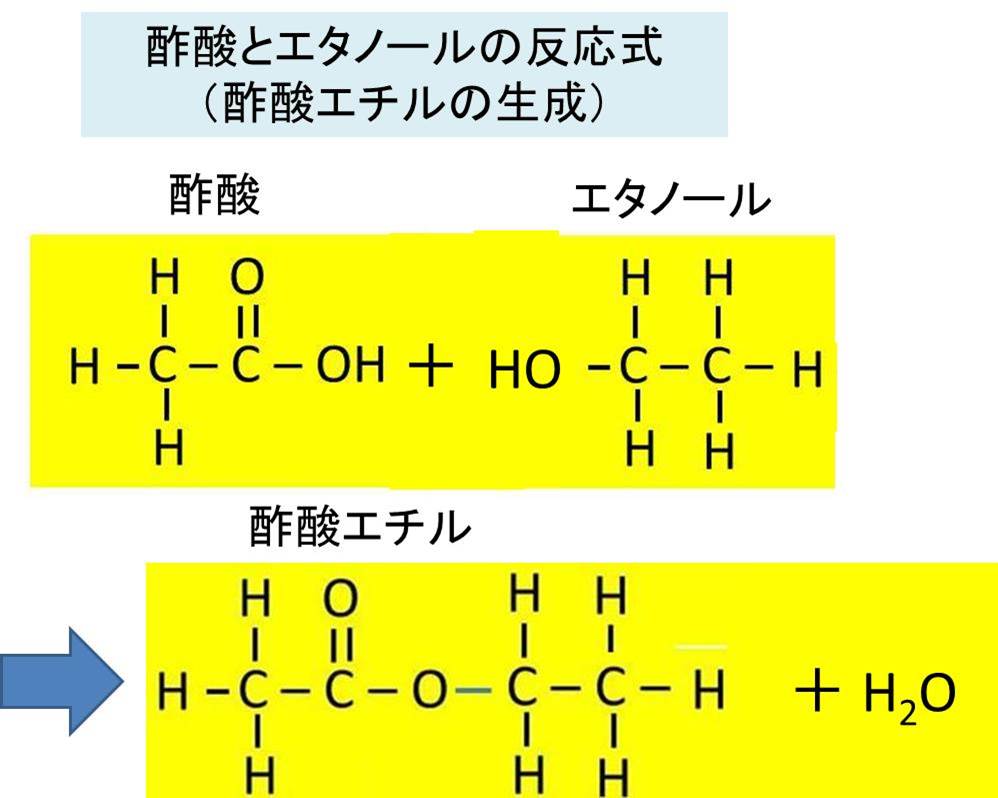



酢酸エチル C4h8o2 の化学式 分子式 構造式 電子式 示性式 分子量は 酢酸とエタノールから酢酸エチルを生成する反応式



組成式




イオン式 電離式まとめ 中学理科 ポイントまとめと整理




授業に潜入 おもしろ学問 自然科学科目群 化学 化学概論 I 中村敏浩 教授 京都大学広報誌 紅萠



組成式の作り方について プラス マイナスのイオンの比で右上の数字が比 Yahoo 知恵袋




有機化学 有機化学の化学結合 Wikibooks




電離式の一覧 中学生用



化学式とは 一覧表 語呂合わせの覚え方 練習問題付き 中学理科 テラコヤプラス By Ameba




化学式 物質の表し方のいろいろ 図解でわかる危険物取扱者講座



2




電離平衡 緩衝液のしくみと働きについて教えてください 化学 定期テスト対策サイト




酢酸 Wikipedia



酢酸の化学式は中学で習う さっきtwitterでこのよう Yahoo 知恵袋




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ



このようになぜ酢酸だけ酸なのに化学式が前に来るんですか 結論を言 Yahoo 知恵袋



2




化学式 物質の表し方のいろいろ 図解でわかる危険物取扱者講座



原子の構造とイオンのでき方に関する問題 Hiromaru Note



酢酸アンモニウム You Iggy




2枚の画像にあるような化学式についてなのですが 矢印が Clearnote



酢酸 You Iggy



受験基礎化学 19 化学反応式と物質量 みかみの参考書ブログ




14 号 アンモニア及びアミンを検出するための 電解質としてイオン液体を備えた電気化学式ガスセンサ Astamuse



電離式の小テスト 3年理科 Takaの授業記録11



バーチャル実験室



イオン式の一覧 中学生用



5分でわかる 中和反応とは 化学反応式と計算問題の解き方 練習問題付き サイエンスストック 高校化学をアニメーションで理解する



化学式とは 一覧表 語呂合わせの覚え方 練習問題付き 中学理科 テラコヤプラス By Ameba




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ




2枚の画像にあるような化学式についてなのですが 矢印が Clearnote




イオン式の覚え方とかあったら教えていただけると助かります お願いします Clearnote




エチレンジアミン四酢酸 Wikipedia
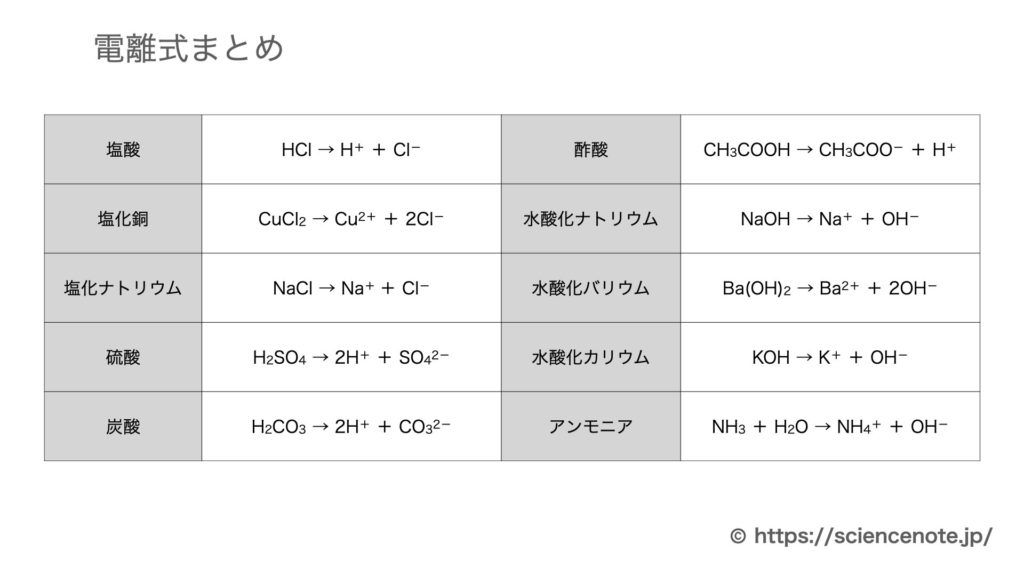



電離とは 電離式まとめ10選 中学化学 Hiromaru Note
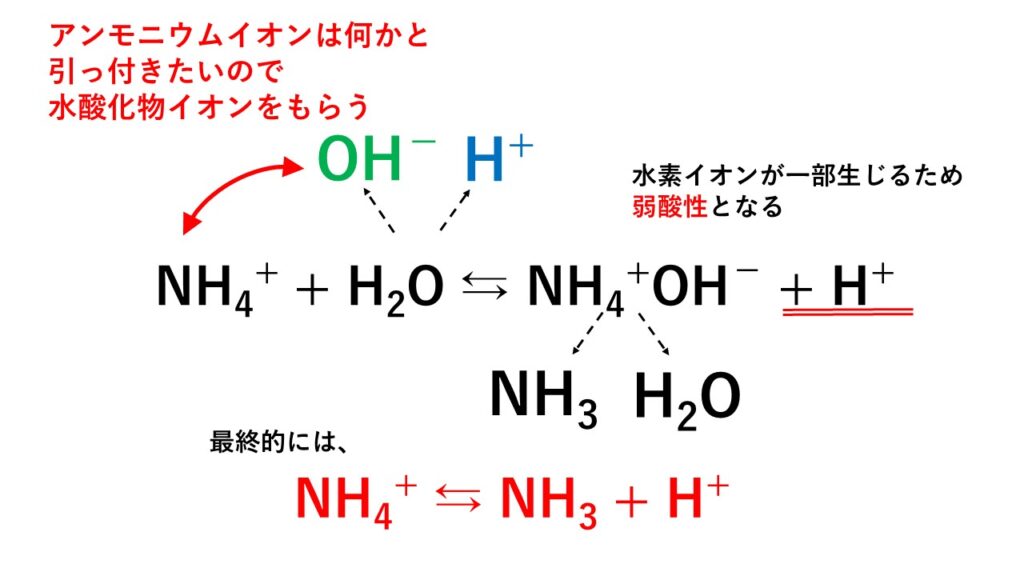



5分でわかる 塩の加水分解と塩の種類と分類 液性を解説 サイエンスストック 高校化学をアニメーションで理解する




イオン式 電離式まとめ 中学理科 ポイントまとめと整理
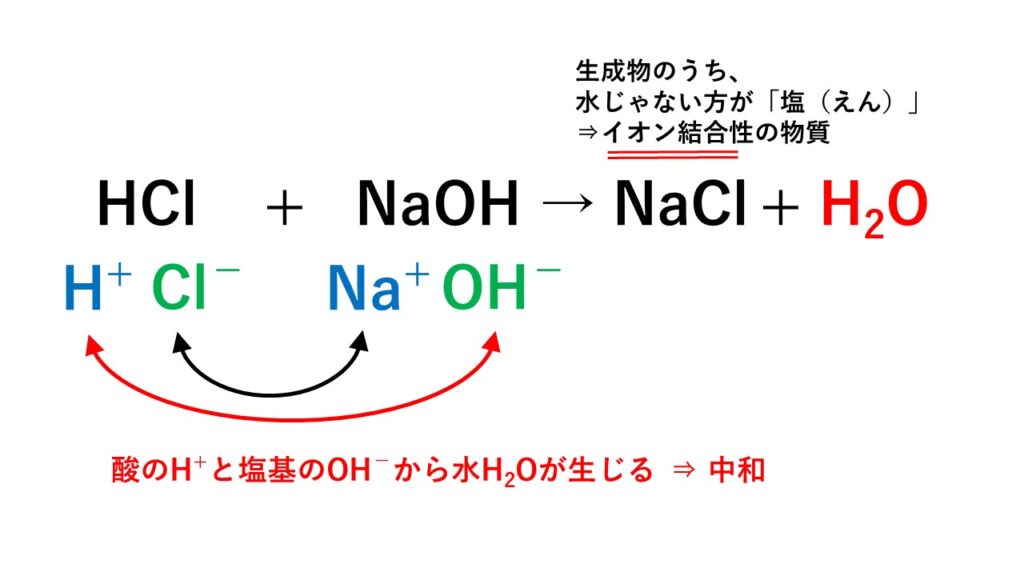



5分でわかる 中和反応とは 化学反応式と計算問題の解き方 練習問題付き サイエンスストック 高校化学をアニメーションで理解する




1 で 酢酸カリウムの化学式をkを先に書いたのですが 答えは後ろでした ど Clearnote




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ
コメント
コメントを投稿